CLL的诊断及鉴别诊断 | 第四届中国慢性淋巴细胞白血病大会
- 分类:白血病
- 作者:
- 来源:互联网
- 发布时间:2021-03-25 14:38
- 访问量:
【概要描述】CLL是一种淋巴增殖性疾病,来源于成熟的单克隆B淋巴细胞。其主要发生在中老年人群中,以淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征。小淋巴细胞淋巴瘤(SLL)与CLL是同一种疾病,是CLL的非白血病表现,统称为CLL/SLL。 CLL诊断 徐卫教授表示,目前随着大众健康意识的提高,CLL多为体检时发现,其诊断的三项标准如下: 1.外周血单克隆B淋巴细胞计数≥5×109/L。(在2016版世界卫生组织[WHO]肿瘤分类中,当外周血单克隆B淋巴细胞计数<5×109/L时,如无髓外病变,即使出现血细胞少或疾病相关症状,也不能诊断为CLL。但2018年更新的国际CLL工作组标准仍将此种情况诊断为CLL。) 2.国际慢性淋巴细胞白血病工作组(iwCLL)的“慢性淋巴细胞白血病诊断、治疗指征、疗效评估及支持治疗指南(2018版)”指出:无论外周血B淋巴细胞多少或淋巴结是否受累,典型骨髓浸润所致的血细胞减少诊断为CLL。徐卫教授表示此种情况少见,但应引起大家重视。 3.外周血涂片中特征性表现为小的、形态成熟的淋巴细胞显著增多,其细胞质少、核致密、核仁不明显、染色质部分聚集,并易见涂抹细胞。外周血淋巴细胞中不典型淋巴细胞及幼稚淋巴细胞≤55%。 典型流式细胞学免疫表型:CD19+、CD5+、CD23+、CD200+、CD10-、FMC7-、CD43+/-;表面免疫球蛋白(slg)、CD20及CD79b弱表达(dim)。根据流式细胞术检测的免疫表型积分(如下表),典型CLL积分在4~5分,0~2分可排除CLL,而3分者需要排除其他类型B细胞慢性淋巴增殖性疾病(B-CLPD)。 此外,骨髓免疫组化LEF1也可帮助诊断CLL,LEF1仅在CLL中表达阳性,在其他B细胞淋巴瘤中均表达阴性。 随后,徐卫教授介绍了CLL/SLL的前驱病变——单克隆B淋巴细胞增多症(MBL),MBL的诊断标准如下: B细胞克隆性异常; 单克隆B淋巴细胞<5×109/L; 无肝、脾、淋巴结肿大(淋巴结长径<1.5cm); 无贫血及血小板减少; 无慢性淋巴增殖性疾病(CLPD)的其他临床症状。 MBL有多种免疫表型,如CLL表型、不典型CLL表型和非CLL表型。徐卫教授强调,当患者出现不典型CLL表型或非CLL表型,需要进行全面检查(如影像学、骨髓活检等),以排除白血病期的非霍奇金淋巴瘤。如果是CLL表型,CLL细胞计数检查为高计数(CLL细胞≥0.5×109/L)MBL的患者需要进行定期随访。 CLL、MBL、SLL具有相同的免疫表型,下图详细区分了这三个概念: CLL鉴别诊断 接下来,徐卫教授分别详细介绍了CLL与其他B-CLPD的鉴别诊断。 1.CLL与MCL 80%的套细胞淋巴瘤(MCL)患者诊断时即处于晚期(Ⅲ/Ⅳ期),90%的MCL患者常伴随结外播散病灶,80%的MZL患者外周血存在MCL细胞(流式细胞学检测比例更高,可达92%)。 套细胞淋巴瘤(MCL)的免疫表型特点为CD5+、Cyclin D1+,同时表达CD19、CD20、CD22和CD79β等。MCL的CD20、slg和CD79β表达比CLL强。大多数MCL患者CD23阴性(25%弱阳性),CD11c阴性。 CD23在鉴别CLL和MCL中具有重要价值:CD23阳性率>92.5%为CLL,<30%为MCL,30%-92.5%则较难判断(如下图)。可通过CD148和CD200进行进一步鉴别:CD148在CLL中弱表达,在MCL中强表达;CD200在CLL中强表达,在MCL中则为阴性(如下图)。 此外,染色体t(11;14)(q13;q32)异常导致CCND1基因与免疫球蛋白重链(IGH)基因易位被认为是MCL的遗传学基础,见于95%以上的MCL患者,可有助于MCL诊断。 2.CLL与FL 徐卫教授表示,滤泡性淋巴瘤(FL)与CLL的鉴别较为容易,FL的免疫表型特点:表达全B细胞标记CD19、CD20、CD22、CD79α、FMC7和生发中心抗原CD10、BCL2、BCL6、CD20荧光强度属于正常淋巴细胞,部分患者CD23阳性,CD5阴性。且80%的FL患者具有t(14;18)(q32;q21)。 3.CLL与SMZL 脾边缘区淋巴瘤(SMZL)常伴巨脾,脾白髓的生发中心、脾门淋巴结受侵犯,骨髓、外周血常受累(细胞膜边缘常伴有绒毛状突起),浅表淋巴结和结外组织罕见受累,30%-40%的SMZL患者可检测到血清单克隆免疫球蛋白。徐卫教授强调,SMZL侵犯骨髓方式常为窦内侵犯,而很少为小梁旁侵犯。 SMZL无特异性抗原表达,因此需要进行排除性诊断,其最低诊断标准如下: 脾组织学+CLL免疫表型积分≤2分; 如不能获得脾组织学检测结果时,典型血液和骨髓形态学+免疫表型+骨髓窦内CD20阳性细胞浸润。 徐卫教授表示,脾肿大患者,如不能获得脾组织学检测结果时,典型的血液和骨髓表现足以诊断。 4.CLL与LPL/WM 淋巴浆细胞淋巴瘤(LPL)是由小B细胞、浆细胞样淋巴细胞和浆细胞组成的恶性肿瘤。华氏巨球蛋白血症(WM)的骨髓中有浆细胞样淋巴细胞浸润,血清中存在单克隆IgM。MYD88 L265P突变是WM最常见的基因突变,但应注意的是,其他淋巴瘤也会具有MYD88 L265P突变。 5.CLL与HCL 毛细胞白血病(HCL)以脾肿大、全血细胞少为主要表现,单核细胞减少为特征性表现。骨髓活检呈“煎鸡蛋样”改变。细胞化学染色抗酒石酸酸性磷酸酶颗粒染色强阳性。免疫表型检测CD11c、CD20等为强阳性。Annexin A1是鉴别HCL的标记之一,在HCL中表达阳性,其他B细胞淋巴瘤中表达阴性。 6.CLL与B-PLL 当排除CLL伴Richter转化、CLL伴幼淋细胞增多、MCL母细胞变异型、MZL伴幼淋细胞增多、毛细胞白血病变异型(HCL-v),且外周血幼淋细胞占淋巴细胞比例≥55%,则可诊断为B幼淋巴细胞白血病(B-PLL)。B-PLL患者中常见复杂核型,且50%的患者p53基因异常。 总结 最后,徐卫教授对B-CLPD的鉴别诊断进行总结(如下图)。她强调,临床中有一类B-CLPD根据临床特点、细胞形态、免疫表型、细胞/分子遗传等检测仍不符合上述任何一亚类,可诊断为B-CLPD-U。这类患者应尽可能多的获得足够组织学标本进行充分诊断,如淋巴结活检、脾切除活检等。
CLL的诊断及鉴别诊断 | 第四届中国慢性淋巴细胞白血病大会
【概要描述】CLL是一种淋巴增殖性疾病,来源于成熟的单克隆B淋巴细胞。其主要发生在中老年人群中,以淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征。小淋巴细胞淋巴瘤(SLL)与CLL是同一种疾病,是CLL的非白血病表现,统称为CLL/SLL。
CLL诊断
徐卫教授表示,目前随着大众健康意识的提高,CLL多为体检时发现,其诊断的三项标准如下:
1.外周血单克隆B淋巴细胞计数≥5×109/L。(在2016版世界卫生组织[WHO]肿瘤分类中,当外周血单克隆B淋巴细胞计数<5×109/L时,如无髓外病变,即使出现血细胞少或疾病相关症状,也不能诊断为CLL。但2018年更新的国际CLL工作组标准仍将此种情况诊断为CLL。)
2.国际慢性淋巴细胞白血病工作组(iwCLL)的“慢性淋巴细胞白血病诊断、治疗指征、疗效评估及支持治疗指南(2018版)”指出:无论外周血B淋巴细胞多少或淋巴结是否受累,典型骨髓浸润所致的血细胞减少诊断为CLL。徐卫教授表示此种情况少见,但应引起大家重视。
3.外周血涂片中特征性表现为小的、形态成熟的淋巴细胞显著增多,其细胞质少、核致密、核仁不明显、染色质部分聚集,并易见涂抹细胞。外周血淋巴细胞中不典型淋巴细胞及幼稚淋巴细胞≤55%。
典型流式细胞学免疫表型:CD19+、CD5+、CD23+、CD200+、CD10-、FMC7-、CD43+/-;表面免疫球蛋白(slg)、CD20及CD79b弱表达(dim)。根据流式细胞术检测的免疫表型积分(如下表),典型CLL积分在4~5分,0~2分可排除CLL,而3分者需要排除其他类型B细胞慢性淋巴增殖性疾病(B-CLPD)。
此外,骨髓免疫组化LEF1也可帮助诊断CLL,LEF1仅在CLL中表达阳性,在其他B细胞淋巴瘤中均表达阴性。
随后,徐卫教授介绍了CLL/SLL的前驱病变——单克隆B淋巴细胞增多症(MBL),MBL的诊断标准如下:
B细胞克隆性异常;
单克隆B淋巴细胞<5×109/L;
无肝、脾、淋巴结肿大(淋巴结长径<1.5cm);
无贫血及血小板减少;
无慢性淋巴增殖性疾病(CLPD)的其他临床症状。
MBL有多种免疫表型,如CLL表型、不典型CLL表型和非CLL表型。徐卫教授强调,当患者出现不典型CLL表型或非CLL表型,需要进行全面检查(如影像学、骨髓活检等),以排除白血病期的非霍奇金淋巴瘤。如果是CLL表型,CLL细胞计数检查为高计数(CLL细胞≥0.5×109/L)MBL的患者需要进行定期随访。
CLL、MBL、SLL具有相同的免疫表型,下图详细区分了这三个概念:
CLL鉴别诊断
接下来,徐卫教授分别详细介绍了CLL与其他B-CLPD的鉴别诊断。
1.CLL与MCL
80%的套细胞淋巴瘤(MCL)患者诊断时即处于晚期(Ⅲ/Ⅳ期),90%的MCL患者常伴随结外播散病灶,80%的MZL患者外周血存在MCL细胞(流式细胞学检测比例更高,可达92%)。
套细胞淋巴瘤(MCL)的免疫表型特点为CD5+、Cyclin D1+,同时表达CD19、CD20、CD22和CD79β等。MCL的CD20、slg和CD79β表达比CLL强。大多数MCL患者CD23阴性(25%弱阳性),CD11c阴性。
CD23在鉴别CLL和MCL中具有重要价值:CD23阳性率>92.5%为CLL,<30%为MCL,30%-92.5%则较难判断(如下图)。可通过CD148和CD200进行进一步鉴别:CD148在CLL中弱表达,在MCL中强表达;CD200在CLL中强表达,在MCL中则为阴性(如下图)。
此外,染色体t(11;14)(q13;q32)异常导致CCND1基因与免疫球蛋白重链(IGH)基因易位被认为是MCL的遗传学基础,见于95%以上的MCL患者,可有助于MCL诊断。
2.CLL与FL
徐卫教授表示,滤泡性淋巴瘤(FL)与CLL的鉴别较为容易,FL的免疫表型特点:表达全B细胞标记CD19、CD20、CD22、CD79α、FMC7和生发中心抗原CD10、BCL2、BCL6、CD20荧光强度属于正常淋巴细胞,部分患者CD23阳性,CD5阴性。且80%的FL患者具有t(14;18)(q32;q21)。
3.CLL与SMZL
脾边缘区淋巴瘤(SMZL)常伴巨脾,脾白髓的生发中心、脾门淋巴结受侵犯,骨髓、外周血常受累(细胞膜边缘常伴有绒毛状突起),浅表淋巴结和结外组织罕见受累,30%-40%的SMZL患者可检测到血清单克隆免疫球蛋白。徐卫教授强调,SMZL侵犯骨髓方式常为窦内侵犯,而很少为小梁旁侵犯。
SMZL无特异性抗原表达,因此需要进行排除性诊断,其最低诊断标准如下:
脾组织学+CLL免疫表型积分≤2分;
如不能获得脾组织学检测结果时,典型血液和骨髓形态学+免疫表型+骨髓窦内CD20阳性细胞浸润。
徐卫教授表示,脾肿大患者,如不能获得脾组织学检测结果时,典型的血液和骨髓表现足以诊断。
4.CLL与LPL/WM
淋巴浆细胞淋巴瘤(LPL)是由小B细胞、浆细胞样淋巴细胞和浆细胞组成的恶性肿瘤。华氏巨球蛋白血症(WM)的骨髓中有浆细胞样淋巴细胞浸润,血清中存在单克隆IgM。MYD88 L265P突变是WM最常见的基因突变,但应注意的是,其他淋巴瘤也会具有MYD88 L265P突变。
5.CLL与HCL
毛细胞白血病(HCL)以脾肿大、全血细胞少为主要表现,单核细胞减少为特征性表现。骨髓活检呈“煎鸡蛋样”改变。细胞化学染色抗酒石酸酸性磷酸酶颗粒染色强阳性。免疫表型检测CD11c、CD20等为强阳性。Annexin A1是鉴别HCL的标记之一,在HCL中表达阳性,其他B细胞淋巴瘤中表达阴性。
6.CLL与B-PLL
当排除CLL伴Richter转化、CLL伴幼淋细胞增多、MCL母细胞变异型、MZL伴幼淋细胞增多、毛细胞白血病变异型(HCL-v),且外周血幼淋细胞占淋巴细胞比例≥55%,则可诊断为B幼淋巴细胞白血病(B-PLL)。B-PLL患者中常见复杂核型,且50%的患者p53基因异常。
总结
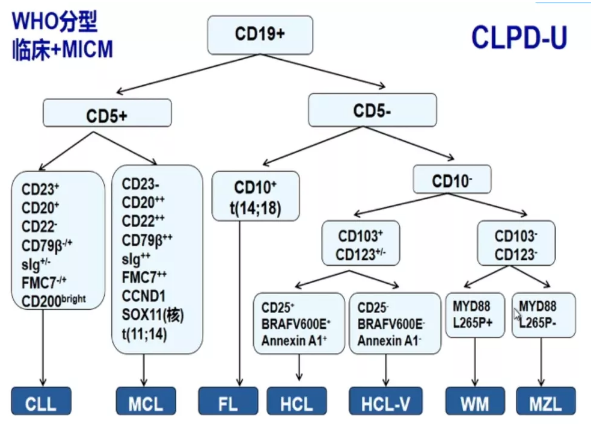
最后,徐卫教授对B-CLPD的鉴别诊断进行总结(如下图)。她强调,临床中有一类B-CLPD根据临床特点、细胞形态、免疫表型、细胞/分子遗传等检测仍不符合上述任何一亚类,可诊断为B-CLPD-U。这类患者应尽可能多的获得足够组织学标本进行充分诊断,如淋巴结活检、脾切除活检等。
- 分类:白血病
- 作者:
- 来源:互联网
- 发布时间:2021-03-25 14:38
- 访问量:
CLL是一种淋巴增殖性疾病,来源于成熟的单克隆B淋巴细胞。其主要发生在中老年人群中,以淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征。小淋巴细胞淋巴瘤(SLL)与CLL是同一种疾病,是CLL的非白血病表现,统称为CLL/SLL。
CLL诊断
徐卫教授表示,目前随着大众健康意识的提高,CLL多为体检时发现,其诊断的三项标准如下:
1.外周血单克隆B淋巴细胞计数≥5×109/L。(在2016版世界卫生组织[WHO]肿瘤分类中,当外周血单克隆B淋巴细胞计数<5×109/L时,如无髓外病变,即使出现血细胞少或疾病相关症状,也不能诊断为CLL。但2018年更新的国际CLL工作组标准仍将此种情况诊断为CLL。)
2.国际慢性淋巴细胞白血病工作组(iwCLL)的“慢性淋巴细胞白血病诊断、治疗指征、疗效评估及支持治疗指南(2018版)”指出:无论外周血B淋巴细胞多少或淋巴结是否受累,典型骨髓浸润所致的血细胞减少诊断为CLL。徐卫教授表示此种情况少见,但应引起大家重视。
3.外周血涂片中特征性表现为小的、形态成熟的淋巴细胞显著增多,其细胞质少、核致密、核仁不明显、染色质部分聚集,并易见涂抹细胞。外周血淋巴细胞中不典型淋巴细胞及幼稚淋巴细胞≤55%。
典型流式细胞学免疫表型:CD19+、CD5+、CD23+、CD200+、CD10-、FMC7-、CD43+/-;表面免疫球蛋白(slg)、CD20及CD79b弱表达(dim)。根据流式细胞术检测的免疫表型积分(如下表),典型CLL积分在4~5分,0~2分可排除CLL,而3分者需要排除其他类型B细胞慢性淋巴增殖性疾病(B-CLPD)。
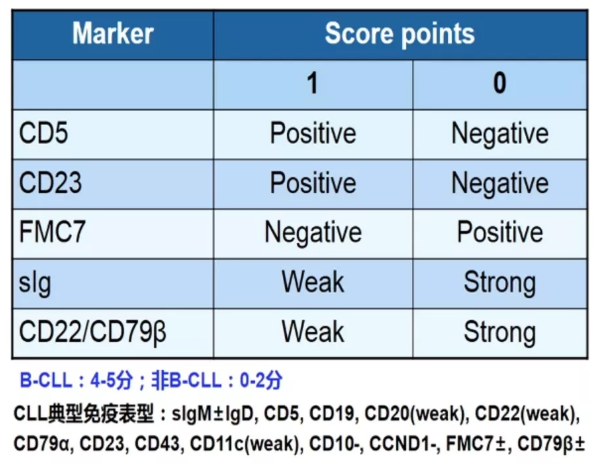
此外,骨髓免疫组化LEF1也可帮助诊断CLL,LEF1仅在CLL中表达阳性,在其他B细胞淋巴瘤中均表达阴性。
随后,徐卫教授介绍了CLL/SLL的前驱病变——单克隆B淋巴细胞增多症(MBL),MBL的诊断标准如下:
B细胞克隆性异常;
单克隆B淋巴细胞<5×109/L;
无肝、脾、淋巴结肿大(淋巴结长径<1.5cm);
无贫血及血小板减少;
无慢性淋巴增殖性疾病(CLPD)的其他临床症状。
MBL有多种免疫表型,如CLL表型、不典型CLL表型和非CLL表型。徐卫教授强调,当患者出现不典型CLL表型或非CLL表型,需要进行全面检查(如影像学、骨髓活检等),以排除白血病期的非霍奇金淋巴瘤。如果是CLL表型,CLL细胞计数检查为高计数(CLL细胞≥0.5×109/L)MBL的患者需要进行定期随访。
CLL、MBL、SLL具有相同的免疫表型,下图详细区分了这三个概念:
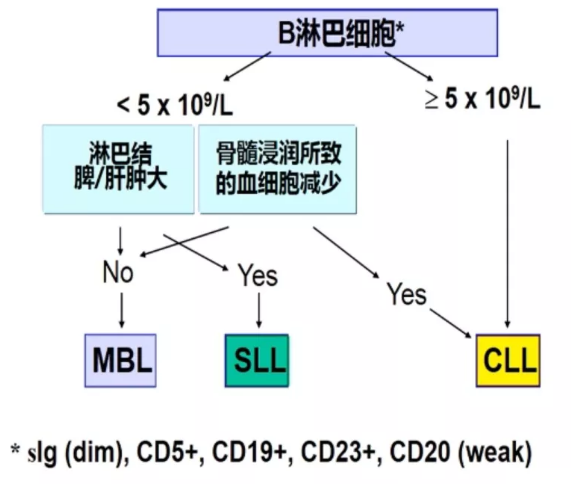
CLL鉴别诊断
接下来,徐卫教授分别详细介绍了CLL与其他B-CLPD的鉴别诊断。
1.CLL与MCL
80%的套细胞淋巴瘤(MCL)患者诊断时即处于晚期(Ⅲ/Ⅳ期),90%的MCL患者常伴随结外播散病灶,80%的MZL患者外周血存在MCL细胞(流式细胞学检测比例更高,可达92%)。
套细胞淋巴瘤(MCL)的免疫表型特点为CD5+、Cyclin D1+,同时表达CD19、CD20、CD22和CD79β等。MCL的CD20、slg和CD79β表达比CLL强。大多数MCL患者CD23阴性(25%弱阳性),CD11c阴性。
CD23在鉴别CLL和MCL中具有重要价值:CD23阳性率>92.5%为CLL,<30%为MCL,30%-92.5%则较难判断(如下图)。可通过CD148和CD200进行进一步鉴别:CD148在CLL中弱表达,在MCL中强表达;CD200在CLL中强表达,在MCL中则为阴性(如下图)。
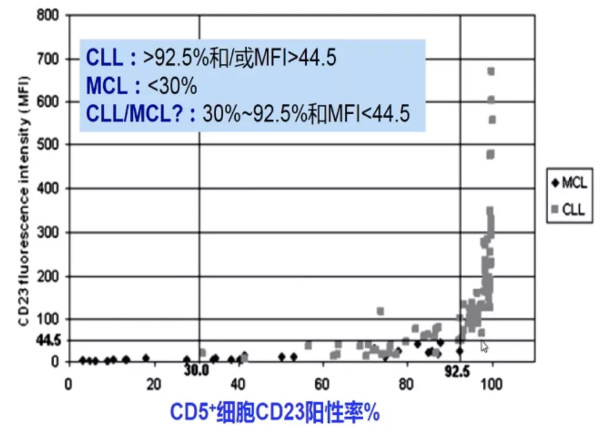
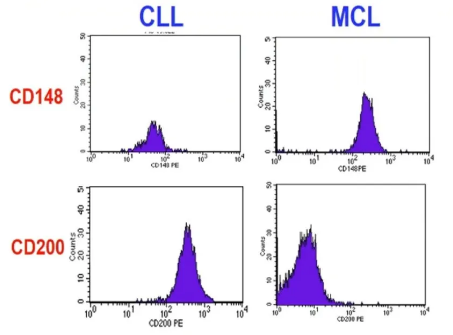
此外,染色体t(11;14)(q13;q32)异常导致CCND1基因与免疫球蛋白重链(IGH)基因易位被认为是MCL的遗传学基础,见于95%以上的MCL患者,可有助于MCL诊断。
2.CLL与FL
徐卫教授表示,滤泡性淋巴瘤(FL)与CLL的鉴别较为容易,FL的免疫表型特点:表达全B细胞标记CD19、CD20、CD22、CD79α、FMC7和生发中心抗原CD10、BCL2、BCL6、CD20荧光强度属于正常淋巴细胞,部分患者CD23阳性,CD5阴性。且80%的FL患者具有t(14;18)(q32;q21)。
3.CLL与SMZL
脾边缘区淋巴瘤(SMZL)常伴巨脾,脾白髓的生发中心、脾门淋巴结受侵犯,骨髓、外周血常受累(细胞膜边缘常伴有绒毛状突起),浅表淋巴结和结外组织罕见受累,30%-40%的SMZL患者可检测到血清单克隆免疫球蛋白。徐卫教授强调,SMZL侵犯骨髓方式常为窦内侵犯,而很少为小梁旁侵犯。
SMZL无特异性抗原表达,因此需要进行排除性诊断,其最低诊断标准如下:
脾组织学+CLL免疫表型积分≤2分;
如不能获得脾组织学检测结果时,典型血液和骨髓形态学+免疫表型+骨髓窦内CD20阳性细胞浸润。
徐卫教授表示,脾肿大患者,如不能获得脾组织学检测结果时,典型的血液和骨髓表现足以诊断。
4.CLL与LPL/WM
淋巴浆细胞淋巴瘤(LPL)是由小B细胞、浆细胞样淋巴细胞和浆细胞组成的恶性肿瘤。华氏巨球蛋白血症(WM)的骨髓中有浆细胞样淋巴细胞浸润,血清中存在单克隆IgM。MYD88 L265P突变是WM最常见的基因突变,但应注意的是,其他淋巴瘤也会具有MYD88 L265P突变。
5.CLL与HCL
毛细胞白血病(HCL)以脾肿大、全血细胞少为主要表现,单核细胞减少为特征性表现。骨髓活检呈“煎鸡蛋样”改变。细胞化学染色抗酒石酸酸性磷酸酶颗粒染色强阳性。免疫表型检测CD11c、CD20等为强阳性。Annexin A1是鉴别HCL的标记之一,在HCL中表达阳性,其他B细胞淋巴瘤中表达阴性。
6.CLL与B-PLL
当排除CLL伴Richter转化、CLL伴幼淋细胞增多、MCL母细胞变异型、MZL伴幼淋细胞增多、毛细胞白血病变异型(HCL-v),且外周血幼淋细胞占淋巴细胞比例≥55%,则可诊断为B幼淋巴细胞白血病(B-PLL)。B-PLL患者中常见复杂核型,且50%的患者p53基因异常。
总结
最后,徐卫教授对B-CLPD的鉴别诊断进行总结(如下图)。她强调,临床中有一类B-CLPD根据临床特点、细胞形态、免疫表型、细胞/分子遗传等检测仍不符合上述任何一亚类,可诊断为B-CLPD-U。这类患者应尽可能多的获得足够组织学标本进行充分诊断,如淋巴结活检、脾切除活检等。
相关信息

服务号

订阅号
无极血康中医医院 冀ICP备05003291号-1 网站建设:中企动力 石家庄 SEO



