慢性髓系白血病三线治疗的现状与未来方向
- 分类:白血病
- 作者:编辑
- 来源:互联网
- 发布时间:2021-04-13 10:45
- 访问量:
【概要描述】靶向BCR-ABL1的ATP竞争性酪氨酸激酶抑制剂(TKI)是治疗费城染色体(Ph)+ 慢性髓系白血病(CML)的主要药物。虽然TKI已经极大改善了CML患者的总体生存,但仍有很多患者会出现治疗失败,且治疗线数越多,预后越差。目前一线和二线CML治疗方案有明确的指南推荐,但是,无论NCCN指南、ELN指南还是中国指南,对三线及以上CML治疗尚无明确的标准方案和指导原则。三线TKI的选择取决于患者的合并症、既往不良事件(AE)、突变特征、药物相互作用和依从性,但治疗选择却相对有限。因此,对两种以上TKI耐药/不耐受的CML患者仍存在很大的未满足需求。 本文为大家盘点了后线CML的现有和在研药物,展望未来可能的治疗方向。 三线CML治疗现状 耐药:一线伊马替尼治疗5年时因耐药转换二线药物的比例为15%-20%[1],二线治疗的耐药率更高,60%-70%患者在治疗两年时不能达到主要分子学缓解(MMR)和完全细胞遗传学缓解(CCyR)[2]。许多CML患者有较高的疾病进展风险,且序贯使用的TKI越多,结局越差。 不耐受:由于脱靶效应,当前TKI存在长期毒性,接受≥2种TKI治疗的患者存在较高的不耐受风险。 突变:序贯使用TKI可导致耐药突变的出现,其中T315I突变会导致对除普纳替尼外的所有现有TKI耐药。在二线治疗中,T315I突变的总体发生率为2-14%,占二线BCR-ABL1所有突变的9-53%[3]。 治疗选择:在对二线治疗不耐受和耐药的病例中,缺乏良好获益的治疗选择。目前国际上常用的三线疗法包括普纳替尼(第三代TKI,未在中国上市)和高三尖杉酯碱(蛋白质翻译抑制剂,诱导荷瘤细胞BCR-ABL1凋亡)。根据ELN 2020建议,对于无显著心血管风险因素且对2代TKI耐药且无特定突变的患者,普纳替尼优于替代2代TKI。异基因造血干细胞移植(allo-SCT)是对几乎全部TKI耐药/不耐受患者的一种选择。如果在诊断的第一年内进行,allo-SCT后的5年生存率为70%,一年以上则为60%。 指南:由于缺乏充分数据,指南中对于三线及以上治疗的推荐也并不明确。虽然各指南都建议了二线患者应转换三线治疗的时机(例如二线6个月或12个月 BCR-ABL1IS>10%),但这类建议的临床获益并没有被确证。指南没有明确规定三线及以上治疗的里程碑,但一般认为BCR-ABL1IS>1%或未达CCyR代表了治疗反应不佳,疾病进展风险较大。 2代TKI用于三线治疗:相关的研究主要为病例数较少的报告,显示长期结局较差。 3代TKI用于三线治疗:国际上已有泊舒替尼和普纳替尼获批用于三线治疗,其核心研究的疗效和安全性见表1。 表1. 泊舒替尼和普纳替尼的核心研究数据 三线CML在研药物 目前正在开发新的BCR-ABL1靶向疗法,重点关注三线和/或具有T315I突变的患者,因为这些患者的治疗选择有限、效果有限。目前在研的三线CML药物概况见表2。 表2. 在研三线BCR-ABL1靶向药物 HQP1351(olverembatinib)[6] HQP1351是一种具有T315I活性的3代TKI。 在I期试验中,分别有94.5%、81%和60.5%的患者达到完全血液学缓解(CHR)、主要细胞遗传学缓解(MCyR)和CCyR,37.2%获得MMR。值得注意的是,携带T315I突变的患者达到CHR、MCyR、CCyR和MMR的人数多于无突变的患者。 两项II期试验:在CC201中,分别有96.8%、75.6%、65.9%和48.8%的患者达到CHR、MCyR、CCyR和MMR。在CC202中,分别有60.9%、52.2%、26.1%的患者达到CHR、MCyR和MMR。在两项研究中,血小板减少是最常见的血液学治疗期间不良事件(TEAE),而最常见的非血液学TEAE是皮肤色素沉着。 PF-114[7] PF-114是另一种3代TKI,在结构上与普纳替尼相似,但进行了改良以避免抑制VEGF-R,努力将心血管毒性降至最低。 在一项包含51名患者的I/II期剂量探索研究中,最佳安全性和疗效剂量队列(300 mg QD)有11名患者。6/11名患者达到MCyR,4/11名患者达到MMR。研究中12名患者有T315I突变,其中3/12和4/12达到CHR和MCyR。11例接受≥400 mg QD的患者报告了3级皮肤毒性。 Vodobatinib(K0706)[8] Vodobatinib也是一种BCR-ABL1 TKI,但对T315I没有活性。 I期数据显示35名患者中,7名患者达到CCyR,4名患者保持CCyR。5名患者达到MMR,2名患者达到MR4.5。在方案修订后,研究排除了携带T315I突变的患者,该方案修订是由两名携带T315I突变的患者在研究的第一个周期中出现疾病进展所致。 Asciminib(ABL001)[9,10] Asciminib是一种新机制的BCR-ABL1抑制剂,机制名为特异性靶向ABL豆蔻酰口袋(Specifically Targeting the ABL Myristoyl Pocket, STAMP)。Asciminib以非ATP竞争性方式与ABL激酶的豆蔻酰口袋结合,因此与TKI具有不同的耐药特征,在对T315I突变有活性的同时,因豆蔻酰口袋的保守性使得脱靶效应得到了有效限制。因为与ATP竞争型TKI作用位点的互补性,Asciminib还可能与TKI协同作用,克服突变,降低TKI相关毒性。 I期试验中,在对≥2种TKI耐药或不耐受的患者中评价了asciminib单药治疗或与伊马替尼、尼洛替尼或达沙替尼联合治疗。探索出无T315I突变的患者推荐剂量为40 mg BID,T315I突变的患者推荐剂量为200 mg BID。 在无T315I突变的患者中,分别有92%、60%、54%的患者达到CHR、MCyR和CCyR。6个月和12个月时分别有24%和36%的患者达到MMR。 在T315I突变患者中,分别有88%、55%和41%的患者达到CHR、MCyR和CCyR。在6个月和12个月时,分别有21%和26%的患者达到MMR。 5种最常见的所有级别TEAE为疲乏(29.3%)、头痛(28.0%)、脂肪酶水平升高(26.7%)、关节痛(24.0%)和恶心(24.0%)。 正在进行的III期试验(ASCEMBL)中,将233例既往接受≥2种TKI治疗的CML-CP成人患者按2:1的比例随机分配,接受Asciminib 40mg BID(n=157)或Bosutinib 500mg QD(n=76)治疗。 第24周,Asciminib组和Bosutinib组的MMR率分别为25.5%和13.2%,达到了主要研究终点。第24周时的其他指标(ASC vs. BOS):MR4:10.8% vs. 5.3%,MR4.5:8.9% vs. 1.3%,CCyR:40.8% vs. 24.2%。 Asciminib组和Bosutinib组中≥3级AE的发生率分别为50.6%和60.5%。最常见的≥3级AE为血小板减少(17.3% vs. 6.6%)、中性粒细胞减少(14.7% vs. 11.8%)、腹泻(0% vs. 10.5%)和丙氨酸转氨酶水平升高(0.6% vs. 14.5%)。Asciminib组因不良事件而终止治疗的比例(5.8%)低于Bosutinib组(21.1%)。 其他非BCR-ABL靶向疗法[11] 几项正在进行的试验正在研究TKI联合各种其他药物的疗效,这些研究都旨在直接降低患者肿瘤负荷,对于后线CML患者具有一定意义,但有待更充分的数据验证。 这些联用药物包括:干扰素-α、PD-1/PD-L1抑制剂、噻唑烷二酮类、二肽基肽酶IV抑制剂、JAK/STAT抑制剂、Wnt/β-catenin抑制剂、脂质体反义寡脱氧核苷酸、TGF-β抑制剂、RAS抑制剂、雷帕霉素抑制剂、组蛋白去乙酰化酶抑制剂、去甲基化药物、极光激酶通路抑制剂和BCL-2抑制剂。 总结 三线及以上CML治疗存在耐药/不耐受率高、缺乏有效治疗选择(尤其是在中国)、缺乏明确指南指导等问题,正在开发的三线疗法主要集中在新的BCR-ABL1 TKI,并致力于解决现有3代TKI的一些主要问题(例如高心血管毒性);此外,也有新一类治疗机制的代表asciminib通过STAMP抑制机制发挥作用,在III期研究中总体疗效和安全性优于泊舒替尼,为CML治疗带来更多可能,可能有助于解决CML后期治疗中的关键未满足需求。
慢性髓系白血病三线治疗的现状与未来方向
【概要描述】靶向BCR-ABL1的ATP竞争性酪氨酸激酶抑制剂(TKI)是治疗费城染色体(Ph)+ 慢性髓系白血病(CML)的主要药物。虽然TKI已经极大改善了CML患者的总体生存,但仍有很多患者会出现治疗失败,且治疗线数越多,预后越差。目前一线和二线CML治疗方案有明确的指南推荐,但是,无论NCCN指南、ELN指南还是中国指南,对三线及以上CML治疗尚无明确的标准方案和指导原则。三线TKI的选择取决于患者的合并症、既往不良事件(AE)、突变特征、药物相互作用和依从性,但治疗选择却相对有限。因此,对两种以上TKI耐药/不耐受的CML患者仍存在很大的未满足需求。
本文为大家盘点了后线CML的现有和在研药物,展望未来可能的治疗方向。
三线CML治疗现状
耐药:一线伊马替尼治疗5年时因耐药转换二线药物的比例为15%-20%[1],二线治疗的耐药率更高,60%-70%患者在治疗两年时不能达到主要分子学缓解(MMR)和完全细胞遗传学缓解(CCyR)[2]。许多CML患者有较高的疾病进展风险,且序贯使用的TKI越多,结局越差。
不耐受:由于脱靶效应,当前TKI存在长期毒性,接受≥2种TKI治疗的患者存在较高的不耐受风险。
突变:序贯使用TKI可导致耐药突变的出现,其中T315I突变会导致对除普纳替尼外的所有现有TKI耐药。在二线治疗中,T315I突变的总体发生率为2-14%,占二线BCR-ABL1所有突变的9-53%[3]。
治疗选择:在对二线治疗不耐受和耐药的病例中,缺乏良好获益的治疗选择。目前国际上常用的三线疗法包括普纳替尼(第三代TKI,未在中国上市)和高三尖杉酯碱(蛋白质翻译抑制剂,诱导荷瘤细胞BCR-ABL1凋亡)。根据ELN 2020建议,对于无显著心血管风险因素且对2代TKI耐药且无特定突变的患者,普纳替尼优于替代2代TKI。异基因造血干细胞移植(allo-SCT)是对几乎全部TKI耐药/不耐受患者的一种选择。如果在诊断的第一年内进行,allo-SCT后的5年生存率为70%,一年以上则为60%。
指南:由于缺乏充分数据,指南中对于三线及以上治疗的推荐也并不明确。虽然各指南都建议了二线患者应转换三线治疗的时机(例如二线6个月或12个月 BCR-ABL1IS>10%),但这类建议的临床获益并没有被确证。指南没有明确规定三线及以上治疗的里程碑,但一般认为BCR-ABL1IS>1%或未达CCyR代表了治疗反应不佳,疾病进展风险较大。
2代TKI用于三线治疗:相关的研究主要为病例数较少的报告,显示长期结局较差。
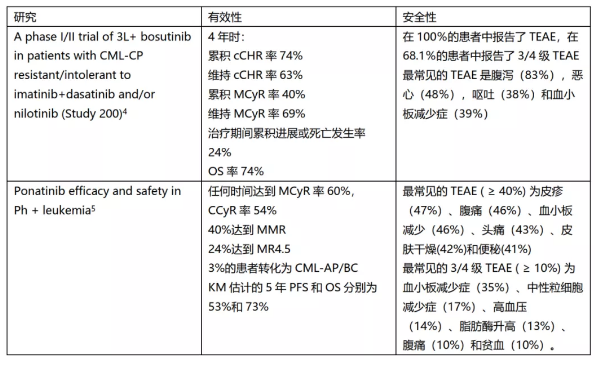
3代TKI用于三线治疗:国际上已有泊舒替尼和普纳替尼获批用于三线治疗,其核心研究的疗效和安全性见表1。
表1. 泊舒替尼和普纳替尼的核心研究数据
三线CML在研药物
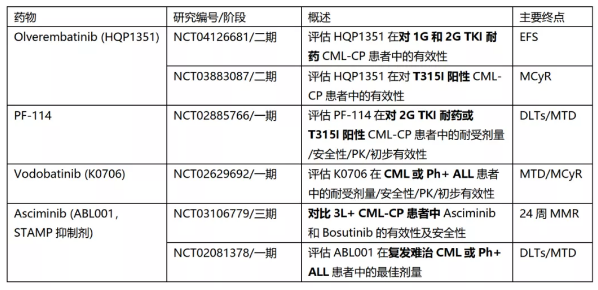
目前正在开发新的BCR-ABL1靶向疗法,重点关注三线和/或具有T315I突变的患者,因为这些患者的治疗选择有限、效果有限。目前在研的三线CML药物概况见表2。
表2. 在研三线BCR-ABL1靶向药物
HQP1351(olverembatinib)[6]
HQP1351是一种具有T315I活性的3代TKI。
在I期试验中,分别有94.5%、81%和60.5%的患者达到完全血液学缓解(CHR)、主要细胞遗传学缓解(MCyR)和CCyR,37.2%获得MMR。值得注意的是,携带T315I突变的患者达到CHR、MCyR、CCyR和MMR的人数多于无突变的患者。
两项II期试验:在CC201中,分别有96.8%、75.6%、65.9%和48.8%的患者达到CHR、MCyR、CCyR和MMR。在CC202中,分别有60.9%、52.2%、26.1%的患者达到CHR、MCyR和MMR。在两项研究中,血小板减少是最常见的血液学治疗期间不良事件(TEAE),而最常见的非血液学TEAE是皮肤色素沉着。
PF-114[7]
PF-114是另一种3代TKI,在结构上与普纳替尼相似,但进行了改良以避免抑制VEGF-R,努力将心血管毒性降至最低。
在一项包含51名患者的I/II期剂量探索研究中,最佳安全性和疗效剂量队列(300 mg QD)有11名患者。6/11名患者达到MCyR,4/11名患者达到MMR。研究中12名患者有T315I突变,其中3/12和4/12达到CHR和MCyR。11例接受≥400 mg QD的患者报告了3级皮肤毒性。
Vodobatinib(K0706)[8]
Vodobatinib也是一种BCR-ABL1 TKI,但对T315I没有活性。
I期数据显示35名患者中,7名患者达到CCyR,4名患者保持CCyR。5名患者达到MMR,2名患者达到MR4.5。在方案修订后,研究排除了携带T315I突变的患者,该方案修订是由两名携带T315I突变的患者在研究的第一个周期中出现疾病进展所致。
Asciminib(ABL001)[9,10]
Asciminib是一种新机制的BCR-ABL1抑制剂,机制名为特异性靶向ABL豆蔻酰口袋(Specifically Targeting the ABL Myristoyl Pocket, STAMP)。Asciminib以非ATP竞争性方式与ABL激酶的豆蔻酰口袋结合,因此与TKI具有不同的耐药特征,在对T315I突变有活性的同时,因豆蔻酰口袋的保守性使得脱靶效应得到了有效限制。因为与ATP竞争型TKI作用位点的互补性,Asciminib还可能与TKI协同作用,克服突变,降低TKI相关毒性。
I期试验中,在对≥2种TKI耐药或不耐受的患者中评价了asciminib单药治疗或与伊马替尼、尼洛替尼或达沙替尼联合治疗。探索出无T315I突变的患者推荐剂量为40 mg BID,T315I突变的患者推荐剂量为200 mg BID。
在无T315I突变的患者中,分别有92%、60%、54%的患者达到CHR、MCyR和CCyR。6个月和12个月时分别有24%和36%的患者达到MMR。
在T315I突变患者中,分别有88%、55%和41%的患者达到CHR、MCyR和CCyR。在6个月和12个月时,分别有21%和26%的患者达到MMR。
5种最常见的所有级别TEAE为疲乏(29.3%)、头痛(28.0%)、脂肪酶水平升高(26.7%)、关节痛(24.0%)和恶心(24.0%)。
正在进行的III期试验(ASCEMBL)中,将233例既往接受≥2种TKI治疗的CML-CP成人患者按2:1的比例随机分配,接受Asciminib 40mg BID(n=157)或Bosutinib 500mg QD(n=76)治疗。
第24周,Asciminib组和Bosutinib组的MMR率分别为25.5%和13.2%,达到了主要研究终点。第24周时的其他指标(ASC vs. BOS):MR4:10.8% vs. 5.3%,MR4.5:8.9% vs. 1.3%,CCyR:40.8% vs. 24.2%。
Asciminib组和Bosutinib组中≥3级AE的发生率分别为50.6%和60.5%。最常见的≥3级AE为血小板减少(17.3% vs. 6.6%)、中性粒细胞减少(14.7% vs. 11.8%)、腹泻(0% vs. 10.5%)和丙氨酸转氨酶水平升高(0.6% vs. 14.5%)。Asciminib组因不良事件而终止治疗的比例(5.8%)低于Bosutinib组(21.1%)。
其他非BCR-ABL靶向疗法[11]
几项正在进行的试验正在研究TKI联合各种其他药物的疗效,这些研究都旨在直接降低患者肿瘤负荷,对于后线CML患者具有一定意义,但有待更充分的数据验证。
这些联用药物包括:干扰素-α、PD-1/PD-L1抑制剂、噻唑烷二酮类、二肽基肽酶IV抑制剂、JAK/STAT抑制剂、Wnt/β-catenin抑制剂、脂质体反义寡脱氧核苷酸、TGF-β抑制剂、RAS抑制剂、雷帕霉素抑制剂、组蛋白去乙酰化酶抑制剂、去甲基化药物、极光激酶通路抑制剂和BCL-2抑制剂。
总结
三线及以上CML治疗存在耐药/不耐受率高、缺乏有效治疗选择(尤其是在中国)、缺乏明确指南指导等问题,正在开发的三线疗法主要集中在新的BCR-ABL1 TKI,并致力于解决现有3代TKI的一些主要问题(例如高心血管毒性);此外,也有新一类治疗机制的代表asciminib通过STAMP抑制机制发挥作用,在III期研究中总体疗效和安全性优于泊舒替尼,为CML治疗带来更多可能,可能有助于解决CML后期治疗中的关键未满足需求。
- 分类:白血病
- 作者:编辑
- 来源:互联网
- 发布时间:2021-04-13 10:45
- 访问量:
靶向BCR-ABL1的ATP竞争性酪氨酸激酶抑制剂(TKI)是治疗费城染色体(Ph)+ 慢性髓系白血病(CML)的主要药物。虽然TKI已经极大改善了CML患者的总体生存,但仍有很多患者会出现治疗失败,且治疗线数越多,预后越差。目前一线和二线CML治疗方案有明确的指南推荐,但是,无论NCCN指南、ELN指南还是中国指南,对三线及以上CML治疗尚无明确的标准方案和指导原则。三线TKI的选择取决于患者的合并症、既往不良事件(AE)、突变特征、药物相互作用和依从性,但治疗选择却相对有限。因此,对两种以上TKI耐药/不耐受的CML患者仍存在很大的未满足需求。
本文为大家盘点了后线CML的现有和在研药物,展望未来可能的治疗方向。
三线CML治疗现状
耐药:一线伊马替尼治疗5年时因耐药转换二线药物的比例为15%-20%[1],二线治疗的耐药率更高,60%-70%患者在治疗两年时不能达到主要分子学缓解(MMR)和完全细胞遗传学缓解(CCyR)[2]。许多CML患者有较高的疾病进展风险,且序贯使用的TKI越多,结局越差。
不耐受:由于脱靶效应,当前TKI存在长期毒性,接受≥2种TKI治疗的患者存在较高的不耐受风险。
突变:序贯使用TKI可导致耐药突变的出现,其中T315I突变会导致对除普纳替尼外的所有现有TKI耐药。在二线治疗中,T315I突变的总体发生率为2-14%,占二线BCR-ABL1所有突变的9-53%[3]。
治疗选择:在对二线治疗不耐受和耐药的病例中,缺乏良好获益的治疗选择。目前国际上常用的三线疗法包括普纳替尼(第三代TKI,未在中国上市)和高三尖杉酯碱(蛋白质翻译抑制剂,诱导荷瘤细胞BCR-ABL1凋亡)。根据ELN 2020建议,对于无显著心血管风险因素且对2代TKI耐药且无特定突变的患者,普纳替尼优于替代2代TKI。异基因造血干细胞移植(allo-SCT)是对几乎全部TKI耐药/不耐受患者的一种选择。如果在诊断的第一年内进行,allo-SCT后的5年生存率为70%,一年以上则为60%。
指南:由于缺乏充分数据,指南中对于三线及以上治疗的推荐也并不明确。虽然各指南都建议了二线患者应转换三线治疗的时机(例如二线6个月或12个月 BCR-ABL1IS>10%),但这类建议的临床获益并没有被确证。指南没有明确规定三线及以上治疗的里程碑,但一般认为BCR-ABL1IS>1%或未达CCyR代表了治疗反应不佳,疾病进展风险较大。
2代TKI用于三线治疗:相关的研究主要为病例数较少的报告,显示长期结局较差。
3代TKI用于三线治疗:国际上已有泊舒替尼和普纳替尼获批用于三线治疗,其核心研究的疗效和安全性见表1。
表1. 泊舒替尼和普纳替尼的核心研究数据
三线CML在研药物
目前正在开发新的BCR-ABL1靶向疗法,重点关注三线和/或具有T315I突变的患者,因为这些患者的治疗选择有限、效果有限。目前在研的三线CML药物概况见表2。
表2. 在研三线BCR-ABL1靶向药物
HQP1351(olverembatinib)[6]
HQP1351是一种具有T315I活性的3代TKI。
在I期试验中,分别有94.5%、81%和60.5%的患者达到完全血液学缓解(CHR)、主要细胞遗传学缓解(MCyR)和CCyR,37.2%获得MMR。值得注意的是,携带T315I突变的患者达到CHR、MCyR、CCyR和MMR的人数多于无突变的患者。
两项II期试验:在CC201中,分别有96.8%、75.6%、65.9%和48.8%的患者达到CHR、MCyR、CCyR和MMR。在CC202中,分别有60.9%、52.2%、26.1%的患者达到CHR、MCyR和MMR。在两项研究中,血小板减少是最常见的血液学治疗期间不良事件(TEAE),而最常见的非血液学TEAE是皮肤色素沉着。
PF-114[7]
PF-114是另一种3代TKI,在结构上与普纳替尼相似,但进行了改良以避免抑制VEGF-R,努力将心血管毒性降至最低。
在一项包含51名患者的I/II期剂量探索研究中,最佳安全性和疗效剂量队列(300 mg QD)有11名患者。6/11名患者达到MCyR,4/11名患者达到MMR。研究中12名患者有T315I突变,其中3/12和4/12达到CHR和MCyR。11例接受≥400 mg QD的患者报告了3级皮肤毒性。
Vodobatinib(K0706)[8]
Vodobatinib也是一种BCR-ABL1 TKI,但对T315I没有活性。
I期数据显示35名患者中,7名患者达到CCyR,4名患者保持CCyR。5名患者达到MMR,2名患者达到MR4.5。在方案修订后,研究排除了携带T315I突变的患者,该方案修订是由两名携带T315I突变的患者在研究的第一个周期中出现疾病进展所致。
Asciminib(ABL001)[9,10]
Asciminib是一种新机制的BCR-ABL1抑制剂,机制名为特异性靶向ABL豆蔻酰口袋(Specifically Targeting the ABL Myristoyl Pocket, STAMP)。Asciminib以非ATP竞争性方式与ABL激酶的豆蔻酰口袋结合,因此与TKI具有不同的耐药特征,在对T315I突变有活性的同时,因豆蔻酰口袋的保守性使得脱靶效应得到了有效限制。因为与ATP竞争型TKI作用位点的互补性,Asciminib还可能与TKI协同作用,克服突变,降低TKI相关毒性。
I期试验中,在对≥2种TKI耐药或不耐受的患者中评价了asciminib单药治疗或与伊马替尼、尼洛替尼或达沙替尼联合治疗。探索出无T315I突变的患者推荐剂量为40 mg BID,T315I突变的患者推荐剂量为200 mg BID。
在无T315I突变的患者中,分别有92%、60%、54%的患者达到CHR、MCyR和CCyR。6个月和12个月时分别有24%和36%的患者达到MMR。
在T315I突变患者中,分别有88%、55%和41%的患者达到CHR、MCyR和CCyR。在6个月和12个月时,分别有21%和26%的患者达到MMR。
5种最常见的所有级别TEAE为疲乏(29.3%)、头痛(28.0%)、脂肪酶水平升高(26.7%)、关节痛(24.0%)和恶心(24.0%)。
正在进行的III期试验(ASCEMBL)中,将233例既往接受≥2种TKI治疗的CML-CP成人患者按2:1的比例随机分配,接受Asciminib 40mg BID(n=157)或Bosutinib 500mg QD(n=76)治疗。
第24周,Asciminib组和Bosutinib组的MMR率分别为25.5%和13.2%,达到了主要研究终点。第24周时的其他指标(ASC vs. BOS):MR4:10.8% vs. 5.3%,MR4.5:8.9% vs. 1.3%,CCyR:40.8% vs. 24.2%。
Asciminib组和Bosutinib组中≥3级AE的发生率分别为50.6%和60.5%。最常见的≥3级AE为血小板减少(17.3% vs. 6.6%)、中性粒细胞减少(14.7% vs. 11.8%)、腹泻(0% vs. 10.5%)和丙氨酸转氨酶水平升高(0.6% vs. 14.5%)。Asciminib组因不良事件而终止治疗的比例(5.8%)低于Bosutinib组(21.1%)。
其他非BCR-ABL靶向疗法[11]
几项正在进行的试验正在研究TKI联合各种其他药物的疗效,这些研究都旨在直接降低患者肿瘤负荷,对于后线CML患者具有一定意义,但有待更充分的数据验证。
这些联用药物包括:干扰素-α、PD-1/PD-L1抑制剂、噻唑烷二酮类、二肽基肽酶IV抑制剂、JAK/STAT抑制剂、Wnt/β-catenin抑制剂、脂质体反义寡脱氧核苷酸、TGF-β抑制剂、RAS抑制剂、雷帕霉素抑制剂、组蛋白去乙酰化酶抑制剂、去甲基化药物、极光激酶通路抑制剂和BCL-2抑制剂。
总结
三线及以上CML治疗存在耐药/不耐受率高、缺乏有效治疗选择(尤其是在中国)、缺乏明确指南指导等问题,正在开发的三线疗法主要集中在新的BCR-ABL1 TKI,并致力于解决现有3代TKI的一些主要问题(例如高心血管毒性);此外,也有新一类治疗机制的代表asciminib通过STAMP抑制机制发挥作用,在III期研究中总体疗效和安全性优于泊舒替尼,为CML治疗带来更多可能,可能有助于解决CML后期治疗中的关键未满足需求。
相关信息

服务号

订阅号
无极血康中医医院 冀ICP备05003291号-1 网站建设:中企动力 石家庄 SEO



