肠道菌群vs恶性血液病
- 分类:医学进展
- 作者:
- 来源:
- 发布时间:2022-02-12 09:20
- 访问量:
【概要描述】关于肠道菌群失衡会导致什么疾病,你可能第一时间想到的是消化系统疾病,而随着医学的不断深入研究,肠道微生物的功能已经彻底颠覆了我们的认知。庞大的细菌群存在于我们的肠道中,无声的控制我们的新陈代谢和免疫系统,现如今肠道微生物已经成为全球癌症领域的研究热点,而近几年关于肠道菌群与恶性血液系统疾病的关系也慢慢引起了人们的关注。 在生理条件下,肠道微生物是一群高度多样化的非致病共生菌,主要由厚壁菌、拟杆菌、放线菌以及变形菌构成。肠道菌群类似一个信号枢纽,它将饮食等环境输入与遗传和免疫信号整合在一起,从而影响宿主的新陈代谢和免疫等反应。一般情况下,肠道菌群保持一定的稳态,从而维持肠道黏膜屏障的完整及功能,当肠道菌群紊乱后会影响肠黏膜的通透性,打破平衡,从而影响宿主的代谢和免疫,影响肿瘤性、代谢性等疾病的发生发展。 最新研究发现肠道微生物可能通过诱导基因突变,通过慢性炎症破坏细胞增殖和凋亡的平衡、启动不必要的固有和适应性免疫反应等,导致血液肿瘤的发生和发展[1]。而血液恶性肿瘤性疾病经过多次化疗、移植及频繁使用广谱抗生素等会打破肠道菌群的稳态,影响肠道菌群的多样性,导致肠道菌群发生紊乱,影响宿主的免疫系统及影响宿主造血恢复。 肠道菌群是先天性和适应性免疫以及造血功能的一个关键的外在调节因子[2]。肠道微生物主要通过其代谢产物短链脂肪酸(short chain fatty acid,SCFA)发挥免疫调节作用,研究发现SCFA能下调促炎性细胞因子IL-6和TNF-α,上调抗炎性细胞因子IL-10,抑制T、B淋巴细胞增殖,SCFA能上调Fas促使T淋巴细胞凋亡并抑制其在炎性肠黏膜处聚集。肠道微生物及SCFA通过上调肠道归巢分子及FoxP3转录分子诱导肠道调节性T细胞(Treg)细胞的分化和增殖,从而调节免疫[3]。宿主通过肠道微生物调节造血的机制是细菌的代谢产物通过血液进入骨髓激活MyD88依赖性TLR途径和NOD1途径,诱导骨髓间充质干细胞产生干扰素,激活STAT1信号通路,作用于造血干/祖细胞,此外,代谢产物中的脂多糖也可直接作用于造血干/祖细胞,通过这两种方式共同抑制造血[4]。对于血液恶性病患者肠道菌群结构与多样性发生改变,主要表现在:肠道大肠埃希菌呈现过度增长趋势,有益菌柔嫩梭菌减少或缺失,以及粪肠球菌、硫磺肠球菌、约氏不动杆菌等肠道内一些细菌呈现特异性增长等,从而去影响疾病的发生、发展,同时增加感染发生和疾病复发的可能[5](见表1)。 表1 血液系统恶性肿瘤微生物群主要特征 对于白血病,研究发现肠道微生态与白血病治疗之间存在相互作用,化疗过程中,微生物群会发生变化,肠道微生物丰富度会逐渐下降,但同时肠道菌群也会反过来影响化疗药物的疗效和毒性。最近的研究发现,化疗前肠道微生物群的多样性和组成可以预测化疗相关的胃肠道反应、粒细胞减少、血流感染等并发症的发生,且这些并发症可以通过调节肠道微生物而得到改善[6]。而对于造血干细胞移植术后,拟杆菌减少,微生物以肠球菌为主,肠球菌及其释放的毒素能加重肠黏膜上皮细胞损伤,此外肠道共生菌比例减少导致Treg细胞生成减少,多种因素加重GVHD,移植后早期发生肠道微生态失调的移植患者后期发生GVHD风险增大,GVHD相关死亡率增高[7]。 移植过程中肠道菌群的变化亦被认为与感染的发生、免疫重建的延迟等相关,同样也可能成为治疗的潜在靶点。目前干预肠道菌群的治疗策略主要包括抗生素应用、饮食调整、益生菌治疗及粪菌移植(FMT),其中FMT作为一种另类的“器官移植”,越来越得到重视。2020年,欧洲血液和骨髓移植学会和中华医学会血液学分会均将FMT列入激素耐药急性移植物抗宿主病(aGVHD)的治疗方案之一。但是FMT对于aGVHD的作用机制仍尚不明确,目前认为健康供体的粪菌可使aGVHD患者肠道菌群结构和功能的失衡状态得到恢复,进而改善相关的临床症状。此外,补充肠道益生菌及其代谢产物、调控肠道区域免疫及全身免疫应答、还原菌群的定植抗性等也可能是FMT发挥作用的潜在机制。FMT通过改变肠道菌群及免疫应答状态,从而影响肿瘤免疫治疗的疗效。但目前,针对肠道菌群、FMT在血液系统肿瘤免疫治疗中的相关研究仍较欠缺,可能成为未来研究的热点。但是,面对血液病患者这一群特殊对象,FMT作为一项新技术应用的安全性和有效性,还有很多问题尚未回答,仍然需要长期、反复和大样本的临床试验进行论证[8]。 参考文献: 1. Yuan L, W ang W, Zhang W, et al. Gut Microbiota in Untreated Diffuse Large B Cell Lymphoma Patients. Front Microbiol.2021,12:646361. 2. 魏同,席亚明,毛夏丽,等.肠道微生态与造血关系的研究进展[J].临床血液学杂志,2020,33(3):229-232. 3. 毛丹,陈宇,盛立霞,等.肠道微生态与血液系统肿瘤患者免疫功能关系的研究现状[J]. 国际输血及血液学杂志,2020,43(5):5. 4. Hannah Y, Baldridge M T, King K Y. Hematopoiesis and the bacterial microbiome[J]. Blood, 2021,132(6):559-564. 5. D'Angelo Christopher R, Sudakaran Sailendharan, Callander Natalie S. Clinical effects and applications of the gut microbiome in hematologic malignancies[J]. Cancer, 2021,127: 679-687. 6. 毛夏丽,席亚明,魏同,等.肠道微生态与白血病的研究进展[J].中国微生态学杂志, 2020,32(12):1476-1481. 7. 王利,高蕊,刘书锋,等.肠道微生物在造血干细胞移植中的作用研究进展[J].中国实验血液学杂志,2018,26(1):5. 8. 吴德沛,赵晔.重视粪菌移植在血液系统疾病治疗中的价值[J].中国实用内科杂志,2021,1(4):265-267.
肠道菌群vs恶性血液病
【概要描述】关于肠道菌群失衡会导致什么疾病,你可能第一时间想到的是消化系统疾病,而随着医学的不断深入研究,肠道微生物的功能已经彻底颠覆了我们的认知。庞大的细菌群存在于我们的肠道中,无声的控制我们的新陈代谢和免疫系统,现如今肠道微生物已经成为全球癌症领域的研究热点,而近几年关于肠道菌群与恶性血液系统疾病的关系也慢慢引起了人们的关注。
在生理条件下,肠道微生物是一群高度多样化的非致病共生菌,主要由厚壁菌、拟杆菌、放线菌以及变形菌构成。肠道菌群类似一个信号枢纽,它将饮食等环境输入与遗传和免疫信号整合在一起,从而影响宿主的新陈代谢和免疫等反应。一般情况下,肠道菌群保持一定的稳态,从而维持肠道黏膜屏障的完整及功能,当肠道菌群紊乱后会影响肠黏膜的通透性,打破平衡,从而影响宿主的代谢和免疫,影响肿瘤性、代谢性等疾病的发生发展。
最新研究发现肠道微生物可能通过诱导基因突变,通过慢性炎症破坏细胞增殖和凋亡的平衡、启动不必要的固有和适应性免疫反应等,导致血液肿瘤的发生和发展[1]。而血液恶性肿瘤性疾病经过多次化疗、移植及频繁使用广谱抗生素等会打破肠道菌群的稳态,影响肠道菌群的多样性,导致肠道菌群发生紊乱,影响宿主的免疫系统及影响宿主造血恢复。
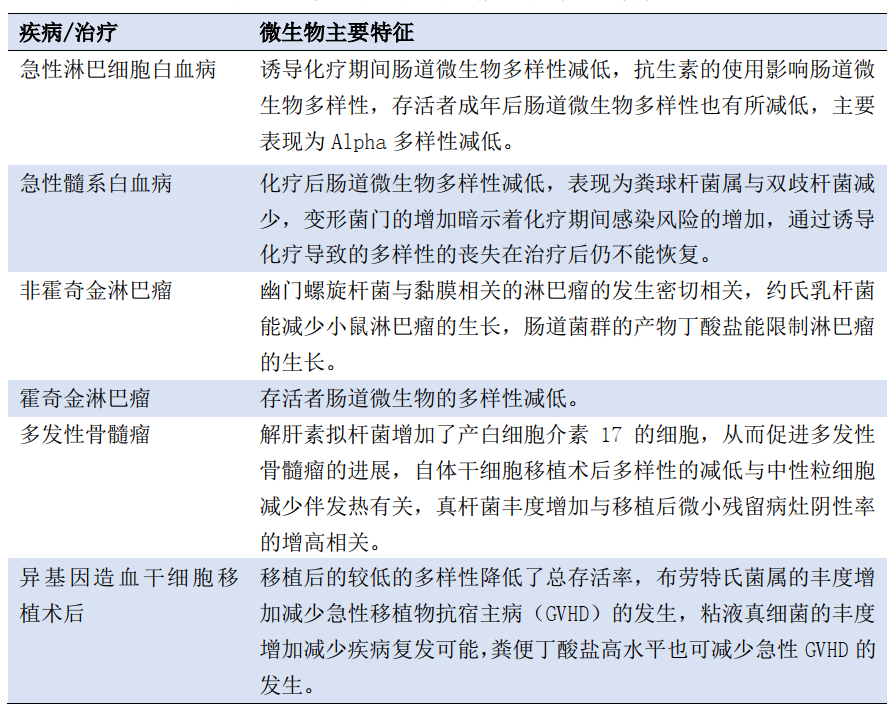
肠道菌群是先天性和适应性免疫以及造血功能的一个关键的外在调节因子[2]。肠道微生物主要通过其代谢产物短链脂肪酸(short chain fatty acid,SCFA)发挥免疫调节作用,研究发现SCFA能下调促炎性细胞因子IL-6和TNF-α,上调抗炎性细胞因子IL-10,抑制T、B淋巴细胞增殖,SCFA能上调Fas促使T淋巴细胞凋亡并抑制其在炎性肠黏膜处聚集。肠道微生物及SCFA通过上调肠道归巢分子及FoxP3转录分子诱导肠道调节性T细胞(Treg)细胞的分化和增殖,从而调节免疫[3]。宿主通过肠道微生物调节造血的机制是细菌的代谢产物通过血液进入骨髓激活MyD88依赖性TLR途径和NOD1途径,诱导骨髓间充质干细胞产生干扰素,激活STAT1信号通路,作用于造血干/祖细胞,此外,代谢产物中的脂多糖也可直接作用于造血干/祖细胞,通过这两种方式共同抑制造血[4]。对于血液恶性病患者肠道菌群结构与多样性发生改变,主要表现在:肠道大肠埃希菌呈现过度增长趋势,有益菌柔嫩梭菌减少或缺失,以及粪肠球菌、硫磺肠球菌、约氏不动杆菌等肠道内一些细菌呈现特异性增长等,从而去影响疾病的发生、发展,同时增加感染发生和疾病复发的可能[5](见表1)。
表1 血液系统恶性肿瘤微生物群主要特征
对于白血病,研究发现肠道微生态与白血病治疗之间存在相互作用,化疗过程中,微生物群会发生变化,肠道微生物丰富度会逐渐下降,但同时肠道菌群也会反过来影响化疗药物的疗效和毒性。最近的研究发现,化疗前肠道微生物群的多样性和组成可以预测化疗相关的胃肠道反应、粒细胞减少、血流感染等并发症的发生,且这些并发症可以通过调节肠道微生物而得到改善[6]。而对于造血干细胞移植术后,拟杆菌减少,微生物以肠球菌为主,肠球菌及其释放的毒素能加重肠黏膜上皮细胞损伤,此外肠道共生菌比例减少导致Treg细胞生成减少,多种因素加重GVHD,移植后早期发生肠道微生态失调的移植患者后期发生GVHD风险增大,GVHD相关死亡率增高[7]。
移植过程中肠道菌群的变化亦被认为与感染的发生、免疫重建的延迟等相关,同样也可能成为治疗的潜在靶点。目前干预肠道菌群的治疗策略主要包括抗生素应用、饮食调整、益生菌治疗及粪菌移植(FMT),其中FMT作为一种另类的“器官移植”,越来越得到重视。2020年,欧洲血液和骨髓移植学会和中华医学会血液学分会均将FMT列入激素耐药急性移植物抗宿主病(aGVHD)的治疗方案之一。但是FMT对于aGVHD的作用机制仍尚不明确,目前认为健康供体的粪菌可使aGVHD患者肠道菌群结构和功能的失衡状态得到恢复,进而改善相关的临床症状。此外,补充肠道益生菌及其代谢产物、调控肠道区域免疫及全身免疫应答、还原菌群的定植抗性等也可能是FMT发挥作用的潜在机制。FMT通过改变肠道菌群及免疫应答状态,从而影响肿瘤免疫治疗的疗效。但目前,针对肠道菌群、FMT在血液系统肿瘤免疫治疗中的相关研究仍较欠缺,可能成为未来研究的热点。但是,面对血液病患者这一群特殊对象,FMT作为一项新技术应用的安全性和有效性,还有很多问题尚未回答,仍然需要长期、反复和大样本的临床试验进行论证[8]。
参考文献:
1. Yuan L, W ang W, Zhang W, et al. Gut Microbiota in Untreated Diffuse Large B Cell Lymphoma Patients. Front Microbiol.2021,12:646361.
2. 魏同,席亚明,毛夏丽,等.肠道微生态与造血关系的研究进展[J].临床血液学杂志,2020,33(3):229-232.
3. 毛丹,陈宇,盛立霞,等.肠道微生态与血液系统肿瘤患者免疫功能关系的研究现状[J]. 国际输血及血液学杂志,2020,43(5):5.
4. Hannah Y, Baldridge M T, King K Y. Hematopoiesis and the bacterial microbiome[J]. Blood, 2021,132(6):559-564.
5. D'Angelo Christopher R, Sudakaran Sailendharan, Callander Natalie S. Clinical effects and applications of the gut microbiome in hematologic malignancies[J]. Cancer, 2021,127: 679-687.
6. 毛夏丽,席亚明,魏同,等.肠道微生态与白血病的研究进展[J].中国微生态学杂志, 2020,32(12):1476-1481.
7. 王利,高蕊,刘书锋,等.肠道微生物在造血干细胞移植中的作用研究进展[J].中国实验血液学杂志,2018,26(1):5.
8. 吴德沛,赵晔.重视粪菌移植在血液系统疾病治疗中的价值[J].中国实用内科杂志,2021,1(4):265-267.
- 分类:医学进展
- 作者:
- 来源:
- 发布时间:2022-02-12 09:20
- 访问量:
关于肠道菌群失衡会导致什么疾病,你可能第一时间想到的是消化系统疾病,而随着医学的不断深入研究,肠道微生物的功能已经彻底颠覆了我们的认知。庞大的细菌群存在于我们的肠道中,无声的控制我们的新陈代谢和免疫系统,现如今肠道微生物已经成为全球癌症领域的研究热点,而近几年关于肠道菌群与恶性血液系统疾病的关系也慢慢引起了人们的关注。
在生理条件下,肠道微生物是一群高度多样化的非致病共生菌,主要由厚壁菌、拟杆菌、放线菌以及变形菌构成。肠道菌群类似一个信号枢纽,它将饮食等环境输入与遗传和免疫信号整合在一起,从而影响宿主的新陈代谢和免疫等反应。一般情况下,肠道菌群保持一定的稳态,从而维持肠道黏膜屏障的完整及功能,当肠道菌群紊乱后会影响肠黏膜的通透性,打破平衡,从而影响宿主的代谢和免疫,影响肿瘤性、代谢性等疾病的发生发展。
最新研究发现肠道微生物可能通过诱导基因突变,通过慢性炎症破坏细胞增殖和凋亡的平衡、启动不必要的固有和适应性免疫反应等,导致血液肿瘤的发生和发展[1]。而血液恶性肿瘤性疾病经过多次化疗、移植及频繁使用广谱抗生素等会打破肠道菌群的稳态,影响肠道菌群的多样性,导致肠道菌群发生紊乱,影响宿主的免疫系统及影响宿主造血恢复。
肠道菌群是先天性和适应性免疫以及造血功能的一个关键的外在调节因子[2]。肠道微生物主要通过其代谢产物短链脂肪酸(short chain fatty acid,SCFA)发挥免疫调节作用,研究发现SCFA能下调促炎性细胞因子IL-6和TNF-α,上调抗炎性细胞因子IL-10,抑制T、B淋巴细胞增殖,SCFA能上调Fas促使T淋巴细胞凋亡并抑制其在炎性肠黏膜处聚集。肠道微生物及SCFA通过上调肠道归巢分子及FoxP3转录分子诱导肠道调节性T细胞(Treg)细胞的分化和增殖,从而调节免疫[3]。宿主通过肠道微生物调节造血的机制是细菌的代谢产物通过血液进入骨髓激活MyD88依赖性TLR途径和NOD1途径,诱导骨髓间充质干细胞产生干扰素,激活STAT1信号通路,作用于造血干/祖细胞,此外,代谢产物中的脂多糖也可直接作用于造血干/祖细胞,通过这两种方式共同抑制造血[4]。对于血液恶性病患者肠道菌群结构与多样性发生改变,主要表现在:肠道大肠埃希菌呈现过度增长趋势,有益菌柔嫩梭菌减少或缺失,以及粪肠球菌、硫磺肠球菌、约氏不动杆菌等肠道内一些细菌呈现特异性增长等,从而去影响疾病的发生、发展,同时增加感染发生和疾病复发的可能[5](见表1)。
表1 血液系统恶性肿瘤微生物群主要特征
对于白血病,研究发现肠道微生态与白血病治疗之间存在相互作用,化疗过程中,微生物群会发生变化,肠道微生物丰富度会逐渐下降,但同时肠道菌群也会反过来影响化疗药物的疗效和毒性。最近的研究发现,化疗前肠道微生物群的多样性和组成可以预测化疗相关的胃肠道反应、粒细胞减少、血流感染等并发症的发生,且这些并发症可以通过调节肠道微生物而得到改善[6]。而对于造血干细胞移植术后,拟杆菌减少,微生物以肠球菌为主,肠球菌及其释放的毒素能加重肠黏膜上皮细胞损伤,此外肠道共生菌比例减少导致Treg细胞生成减少,多种因素加重GVHD,移植后早期发生肠道微生态失调的移植患者后期发生GVHD风险增大,GVHD相关死亡率增高[7]。
移植过程中肠道菌群的变化亦被认为与感染的发生、免疫重建的延迟等相关,同样也可能成为治疗的潜在靶点。目前干预肠道菌群的治疗策略主要包括抗生素应用、饮食调整、益生菌治疗及粪菌移植(FMT),其中FMT作为一种另类的“器官移植”,越来越得到重视。2020年,欧洲血液和骨髓移植学会和中华医学会血液学分会均将FMT列入激素耐药急性移植物抗宿主病(aGVHD)的治疗方案之一。但是FMT对于aGVHD的作用机制仍尚不明确,目前认为健康供体的粪菌可使aGVHD患者肠道菌群结构和功能的失衡状态得到恢复,进而改善相关的临床症状。此外,补充肠道益生菌及其代谢产物、调控肠道区域免疫及全身免疫应答、还原菌群的定植抗性等也可能是FMT发挥作用的潜在机制。FMT通过改变肠道菌群及免疫应答状态,从而影响肿瘤免疫治疗的疗效。但目前,针对肠道菌群、FMT在血液系统肿瘤免疫治疗中的相关研究仍较欠缺,可能成为未来研究的热点。但是,面对血液病患者这一群特殊对象,FMT作为一项新技术应用的安全性和有效性,还有很多问题尚未回答,仍然需要长期、反复和大样本的临床试验进行论证[8]。
参考文献:
1. Yuan L, W ang W, Zhang W, et al. Gut Microbiota in Untreated Diffuse Large B Cell Lymphoma Patients. Front Microbiol.2021,12:646361.
2. 魏同,席亚明,毛夏丽,等.肠道微生态与造血关系的研究进展[J].临床血液学杂志,2020,33(3):229-232.
3. 毛丹,陈宇,盛立霞,等.肠道微生态与血液系统肿瘤患者免疫功能关系的研究现状[J]. 国际输血及血液学杂志,2020,43(5):5.
4. Hannah Y, Baldridge M T, King K Y. Hematopoiesis and the bacterial microbiome[J]. Blood, 2021,132(6):559-564.
5. D'Angelo Christopher R, Sudakaran Sailendharan, Callander Natalie S. Clinical effects and applications of the gut microbiome in hematologic malignancies[J]. Cancer, 2021,127: 679-687.
6. 毛夏丽,席亚明,魏同,等.肠道微生态与白血病的研究进展[J].中国微生态学杂志, 2020,32(12):1476-1481.
7. 王利,高蕊,刘书锋,等.肠道微生物在造血干细胞移植中的作用研究进展[J].中国实验血液学杂志,2018,26(1):5.
8. 吴德沛,赵晔.重视粪菌移植在血液系统疾病治疗中的价值[J].中国实用内科杂志,2021,1(4):265-267.
相关信息

服务号

订阅号
无极血康中医医院 冀ICP备05003291号-1 网站建设:中企动力 石家庄 SEO



