MRD或可指导复发/难治慢性淋巴细胞白血病患者治疗
- 分类:白血病
- 作者:编辑
- 来源:互联网
- 发布时间:2022-08-09 15:20
- 访问量:
【概要描述】布鲁顿酪氨酸激酶(BTK)抑制剂伊布替尼单药持续应用可使复发/难治慢性淋巴细胞白血病(R/R CLL)患者无进展生存期(PFS)显著延长。高选择性B淋巴细胞瘤-2(BCL2)抑制剂维奈克拉无论是单药应用或联合利妥昔单抗的固定疗程治疗均能使R/R CLL患者获得长期缓解。但这些方案并不能治愈R/R CLL,且由于反复或持续用药,患者可能产生耐药并导致疾病进展。一项II期试验结果表明,伊布替尼和维奈克拉联合一线治疗R/R CLL疗效较好。已有证据表明,对于持续完全分子学缓解的慢性髓系白血病患者,可安全地停止靶向治疗。微小残留病(MRD)阴性可作为R/R CLL患者深度缓解的替代性标志物。基于此,有研究者开展了一项开放标签的随机II期试验,旨在探究MRD指导下对R/R CLL停止或重新开始治疗是否可行。 研究方法 纳入标准:(1)年龄≥18岁;(2)既往治疗线数≥1;(3)伴/不伴TP53基因突变;(4)未暴露过BTK抑制剂或BCL2抑制剂;(5)肌酐清除率≥30mL/min。以28天为一个周期,所有患者接受15个周期的伊布替尼治疗(口服420mg每日一次[QD]),前2个周期为伊布替尼单药治疗,第3周期的第1天起加用维奈克拉。维奈克拉起始剂量为20mg QD,之后按照50mg、100mg、200mg、400mg QD每周剂量递增,然后400mg QD维持至15个周期结束。 在第9和12个周期结束时,对患者进行外周血MRD评估;第15个周期的第15天,对患者进行外周血和骨髓MRD评估。治疗开始后的第27个月进行第2次骨髓MRD评估。对于15个周期的第15天MRD阴性的患者,在15个治疗周期完成后进行随机分组(1:2),继续进行伊布替尼治疗或停止治疗(图1)。此后,2年内每3个月随访一次,第3年开始,每4个月随访一次,对患者进行外周血MRD评估。对于MRD转阳或再次出现CLL症状的患者重新开始12个周期的伊布替尼+维奈克拉治疗后,采用伊布替尼继续治疗直到不可耐受的毒性或疾病进展。 图1 主要终点为:停止治疗组患者停止治疗12个月后(开始治疗27个月)总生存(OS)率。次要终点:所有患者第9、12、15周期以及停止治疗后的MRD水平,PFS,OS和总缓解率(ORR)等。 研究结果 患者基线特征 2017年7月12日至2019年1月21日共入组了225例患者,中位年龄为68岁(IQR 61-72)。男性占比70%(n=157),女性占比30%(n=68)。160例患者(71%)接受过标准化学免疫治疗。222例检测到基因组异常的患者中有59例患者(27%)有基因组复杂性(定义为≥3个基因突变)。患者基线特征见表1。 表1 疗效分析 在第15周期,225例意向治疗人群中,有81例患者(36%)获得外周血和骨髓MRD阴性,112例(50%)获得外周血MRD阴性,84例(37%)获得骨髓MRD阴性。治疗期间,第9周期(74例患者[33%]MRD阴性)到第12周期(99例患者[44%]MRD阴性)外周血MRD情况改善。经过15个周期的治疗,225例患者的ORR为86%,完全缓解(CR)率为64%(图2)。 图2 225例患者中,有188例患者(84%)完成了维奈克拉联合伊布替尼治疗,直到第15个周期进行随机分组。188例患者中有107例患者获得外周血MRD阴性,其中78例患者(73%)获得骨髓MRD阴性。225例患者中有72例外周血和骨髓MRD阴性患者接受了随机分组(24例患者继续予以伊布替尼治疗,48例患者停止用药)。 截至2021年6月22日,中位随访34.4个月(IQR 30.6-37.9),208例患者存活且未失访。225例患者的预估27个月PFS率为88%(95%CI 83-92),预估27个月OS率为94%(95%CI 90-97)。研究达到主要终点,随机分组后停止治疗组27个月PFS率为98%(95%CI 89–100),高于预先设定的75%;继续予以伊布替尼治疗组患者预估27个月PFS率为96%(95%CI 79-100)。 安全性分析 在随机分组前的15个周期中,225例患者中有206例患者(92%)报告了≥1次不良事件(AE)。225例患者中有107例(48%)发生严重AE。感染(130/225,58%)、中性粒细胞减少(91/225,40%)和胃肠道不良事件(53/225,24%)是前15个周期中报告最常见的AE。在维奈克拉剂量爬坡期间,225例患者中有11例患者(5%)报告了2-3级肿瘤溶解综合征(TLS),均为实验室TLS。 15个周期后,未进行随机分组且继续进行伊布替尼维持治疗的116例患者中,有46例患者(40%)在治疗中发生严重AE。随机分组后,24例继续伊布替尼治疗患者中,有8例患者(33%)发生严重AE,1例患者(4%)发生房颤;48例停止治疗患者中,有4例患者(8%)发生严重AE,未报告有房颤(表2)。 表2 研究结论 在MRD的指导下,伊布替尼+维奈克拉限时治疗对R/R CLL具有有利的获益-风险特征。但考虑试验的局限性,研究结果应被认为是描述性结果,关于长期生存的决定性数据尚待公布。停止治疗后无患者发生疾病进展,随访中MRD复阳和再次出现CLL症状的患者成功地重新开始治疗,这提示在MRD指导下停止治疗或基于MRD对R/R CLL患者重新开始靶向治疗是可行的。 参考来源: Kater AP, et al. Minimal residual disease-guided stop and start of venetoclax plus ibrutinib for patients with relapsed or refractory chronic lymphocytic leukaemia (HOVON141/VISION): primary analysis of an open-label, randomised, phase 2 trial. Lancet Oncol. 2022 Jun;23(6):818-828.
MRD或可指导复发/难治慢性淋巴细胞白血病患者治疗
【概要描述】布鲁顿酪氨酸激酶(BTK)抑制剂伊布替尼单药持续应用可使复发/难治慢性淋巴细胞白血病(R/R CLL)患者无进展生存期(PFS)显著延长。高选择性B淋巴细胞瘤-2(BCL2)抑制剂维奈克拉无论是单药应用或联合利妥昔单抗的固定疗程治疗均能使R/R CLL患者获得长期缓解。但这些方案并不能治愈R/R CLL,且由于反复或持续用药,患者可能产生耐药并导致疾病进展。一项II期试验结果表明,伊布替尼和维奈克拉联合一线治疗R/R CLL疗效较好。已有证据表明,对于持续完全分子学缓解的慢性髓系白血病患者,可安全地停止靶向治疗。微小残留病(MRD)阴性可作为R/R CLL患者深度缓解的替代性标志物。基于此,有研究者开展了一项开放标签的随机II期试验,旨在探究MRD指导下对R/R CLL停止或重新开始治疗是否可行。
研究方法
纳入标准:(1)年龄≥18岁;(2)既往治疗线数≥1;(3)伴/不伴TP53基因突变;(4)未暴露过BTK抑制剂或BCL2抑制剂;(5)肌酐清除率≥30mL/min。以28天为一个周期,所有患者接受15个周期的伊布替尼治疗(口服420mg每日一次[QD]),前2个周期为伊布替尼单药治疗,第3周期的第1天起加用维奈克拉。维奈克拉起始剂量为20mg QD,之后按照50mg、100mg、200mg、400mg QD每周剂量递增,然后400mg QD维持至15个周期结束。
在第9和12个周期结束时,对患者进行外周血MRD评估;第15个周期的第15天,对患者进行外周血和骨髓MRD评估。治疗开始后的第27个月进行第2次骨髓MRD评估。对于15个周期的第15天MRD阴性的患者,在15个治疗周期完成后进行随机分组(1:2),继续进行伊布替尼治疗或停止治疗(图1)。此后,2年内每3个月随访一次,第3年开始,每4个月随访一次,对患者进行外周血MRD评估。对于MRD转阳或再次出现CLL症状的患者重新开始12个周期的伊布替尼+维奈克拉治疗后,采用伊布替尼继续治疗直到不可耐受的毒性或疾病进展。
图1
主要终点为:停止治疗组患者停止治疗12个月后(开始治疗27个月)总生存(OS)率。次要终点:所有患者第9、12、15周期以及停止治疗后的MRD水平,PFS,OS和总缓解率(ORR)等。
研究结果
患者基线特征
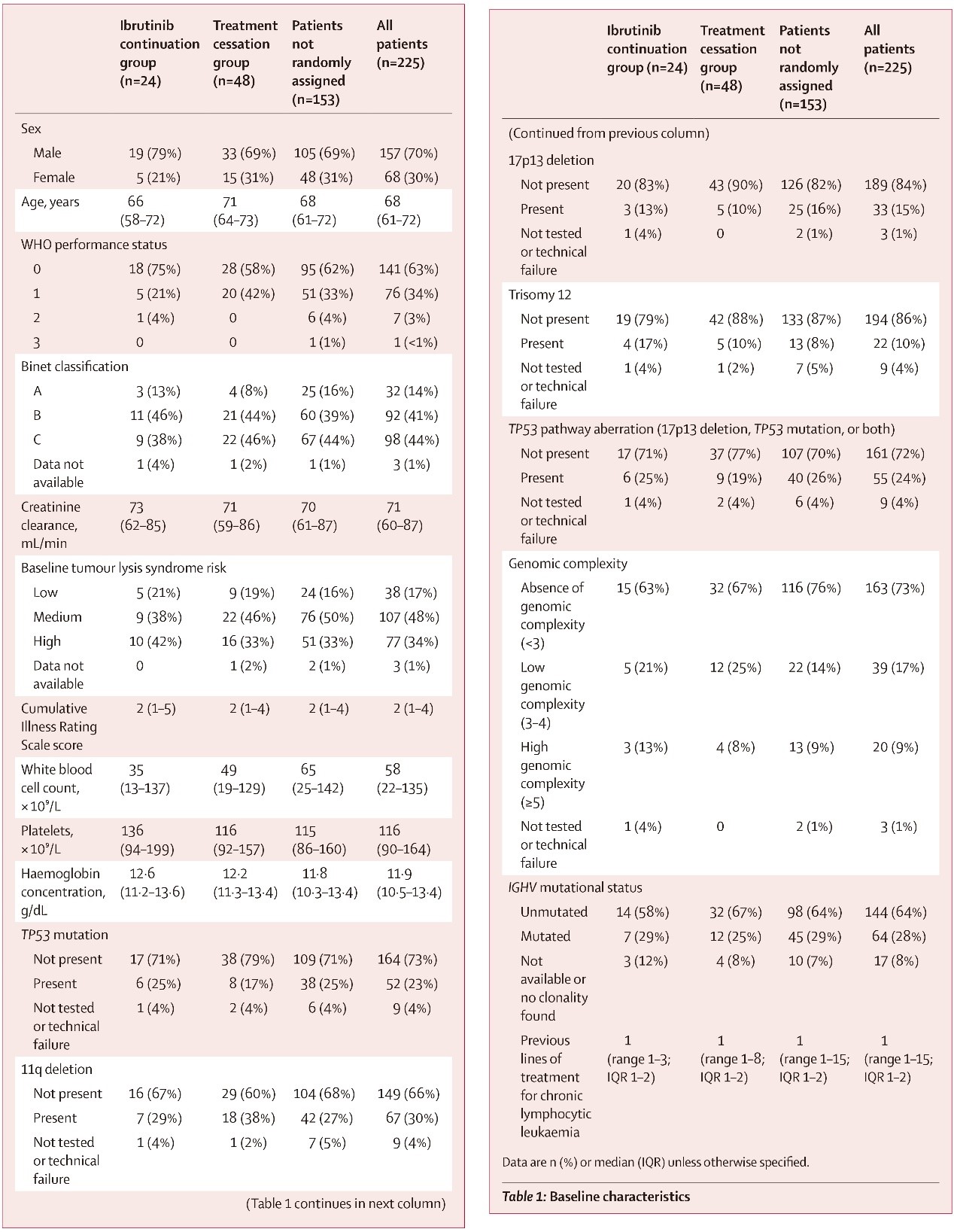
2017年7月12日至2019年1月21日共入组了225例患者,中位年龄为68岁(IQR 61-72)。男性占比70%(n=157),女性占比30%(n=68)。160例患者(71%)接受过标准化学免疫治疗。222例检测到基因组异常的患者中有59例患者(27%)有基因组复杂性(定义为≥3个基因突变)。患者基线特征见表1。
表1
疗效分析
在第15周期,225例意向治疗人群中,有81例患者(36%)获得外周血和骨髓MRD阴性,112例(50%)获得外周血MRD阴性,84例(37%)获得骨髓MRD阴性。治疗期间,第9周期(74例患者[33%]MRD阴性)到第12周期(99例患者[44%]MRD阴性)外周血MRD情况改善。经过15个周期的治疗,225例患者的ORR为86%,完全缓解(CR)率为64%(图2)。
图2
225例患者中,有188例患者(84%)完成了维奈克拉联合伊布替尼治疗,直到第15个周期进行随机分组。188例患者中有107例患者获得外周血MRD阴性,其中78例患者(73%)获得骨髓MRD阴性。225例患者中有72例外周血和骨髓MRD阴性患者接受了随机分组(24例患者继续予以伊布替尼治疗,48例患者停止用药)。
截至2021年6月22日,中位随访34.4个月(IQR 30.6-37.9),208例患者存活且未失访。225例患者的预估27个月PFS率为88%(95%CI 83-92),预估27个月OS率为94%(95%CI 90-97)。研究达到主要终点,随机分组后停止治疗组27个月PFS率为98%(95%CI 89–100),高于预先设定的75%;继续予以伊布替尼治疗组患者预估27个月PFS率为96%(95%CI 79-100)。
安全性分析
在随机分组前的15个周期中,225例患者中有206例患者(92%)报告了≥1次不良事件(AE)。225例患者中有107例(48%)发生严重AE。感染(130/225,58%)、中性粒细胞减少(91/225,40%)和胃肠道不良事件(53/225,24%)是前15个周期中报告最常见的AE。在维奈克拉剂量爬坡期间,225例患者中有11例患者(5%)报告了2-3级肿瘤溶解综合征(TLS),均为实验室TLS。
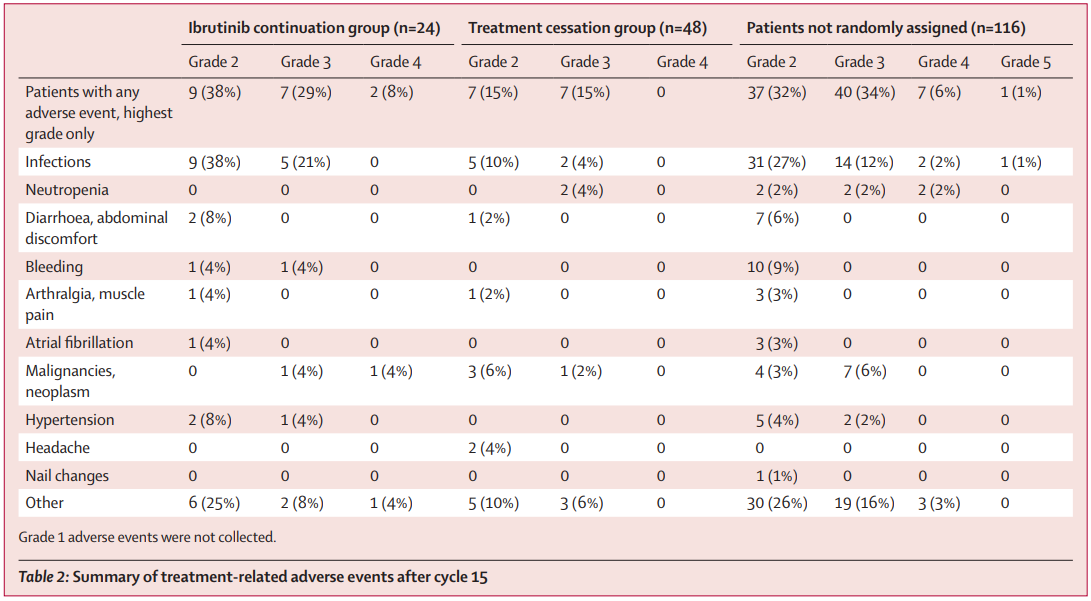
15个周期后,未进行随机分组且继续进行伊布替尼维持治疗的116例患者中,有46例患者(40%)在治疗中发生严重AE。随机分组后,24例继续伊布替尼治疗患者中,有8例患者(33%)发生严重AE,1例患者(4%)发生房颤;48例停止治疗患者中,有4例患者(8%)发生严重AE,未报告有房颤(表2)。
表2
研究结论
在MRD的指导下,伊布替尼+维奈克拉限时治疗对R/R CLL具有有利的获益-风险特征。但考虑试验的局限性,研究结果应被认为是描述性结果,关于长期生存的决定性数据尚待公布。停止治疗后无患者发生疾病进展,随访中MRD复阳和再次出现CLL症状的患者成功地重新开始治疗,这提示在MRD指导下停止治疗或基于MRD对R/R CLL患者重新开始靶向治疗是可行的。
参考来源:
Kater AP, et al. Minimal residual disease-guided stop and start of venetoclax plus ibrutinib for patients with relapsed or refractory chronic lymphocytic leukaemia (HOVON141/VISION): primary analysis of an open-label, randomised, phase 2 trial. Lancet Oncol. 2022 Jun;23(6):818-828.
- 分类:白血病
- 作者:编辑
- 来源:互联网
- 发布时间:2022-08-09 15:20
- 访问量:
布鲁顿酪氨酸激酶(BTK)抑制剂伊布替尼单药持续应用可使复发/难治慢性淋巴细胞白血病(R/R CLL)患者无进展生存期(PFS)显著延长。高选择性B淋巴细胞瘤-2(BCL2)抑制剂维奈克拉无论是单药应用或联合利妥昔单抗的固定疗程治疗均能使R/R CLL患者获得长期缓解。但这些方案并不能治愈R/R CLL,且由于反复或持续用药,患者可能产生耐药并导致疾病进展。一项II期试验结果表明,伊布替尼和维奈克拉联合一线治疗R/R CLL疗效较好。已有证据表明,对于持续完全分子学缓解的慢性髓系白血病患者,可安全地停止靶向治疗。微小残留病(MRD)阴性可作为R/R CLL患者深度缓解的替代性标志物。基于此,有研究者开展了一项开放标签的随机II期试验,旨在探究MRD指导下对R/R CLL停止或重新开始治疗是否可行。
研究方法
纳入标准:(1)年龄≥18岁;(2)既往治疗线数≥1;(3)伴/不伴TP53基因突变;(4)未暴露过BTK抑制剂或BCL2抑制剂;(5)肌酐清除率≥30mL/min。以28天为一个周期,所有患者接受15个周期的伊布替尼治疗(口服420mg每日一次[QD]),前2个周期为伊布替尼单药治疗,第3周期的第1天起加用维奈克拉。维奈克拉起始剂量为20mg QD,之后按照50mg、100mg、200mg、400mg QD每周剂量递增,然后400mg QD维持至15个周期结束。
在第9和12个周期结束时,对患者进行外周血MRD评估;第15个周期的第15天,对患者进行外周血和骨髓MRD评估。治疗开始后的第27个月进行第2次骨髓MRD评估。对于15个周期的第15天MRD阴性的患者,在15个治疗周期完成后进行随机分组(1:2),继续进行伊布替尼治疗或停止治疗(图1)。此后,2年内每3个月随访一次,第3年开始,每4个月随访一次,对患者进行外周血MRD评估。对于MRD转阳或再次出现CLL症状的患者重新开始12个周期的伊布替尼+维奈克拉治疗后,采用伊布替尼继续治疗直到不可耐受的毒性或疾病进展。
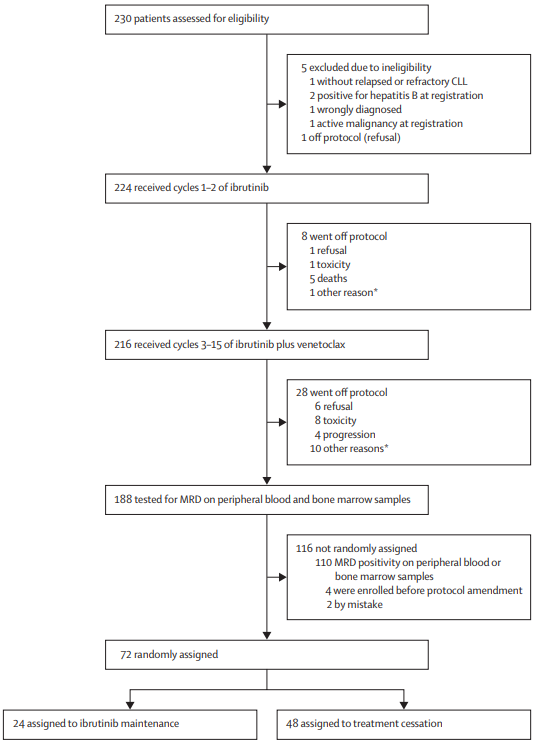
图1
主要终点为:停止治疗组患者停止治疗12个月后(开始治疗27个月)总生存(OS)率。次要终点:所有患者第9、12、15周期以及停止治疗后的MRD水平,PFS,OS和总缓解率(ORR)等。
研究结果
患者基线特征
2017年7月12日至2019年1月21日共入组了225例患者,中位年龄为68岁(IQR 61-72)。男性占比70%(n=157),女性占比30%(n=68)。160例患者(71%)接受过标准化学免疫治疗。222例检测到基因组异常的患者中有59例患者(27%)有基因组复杂性(定义为≥3个基因突变)。患者基线特征见表1。
表1
疗效分析
在第15周期,225例意向治疗人群中,有81例患者(36%)获得外周血和骨髓MRD阴性,112例(50%)获得外周血MRD阴性,84例(37%)获得骨髓MRD阴性。治疗期间,第9周期(74例患者[33%]MRD阴性)到第12周期(99例患者[44%]MRD阴性)外周血MRD情况改善。经过15个周期的治疗,225例患者的ORR为86%,完全缓解(CR)率为64%(图2)。
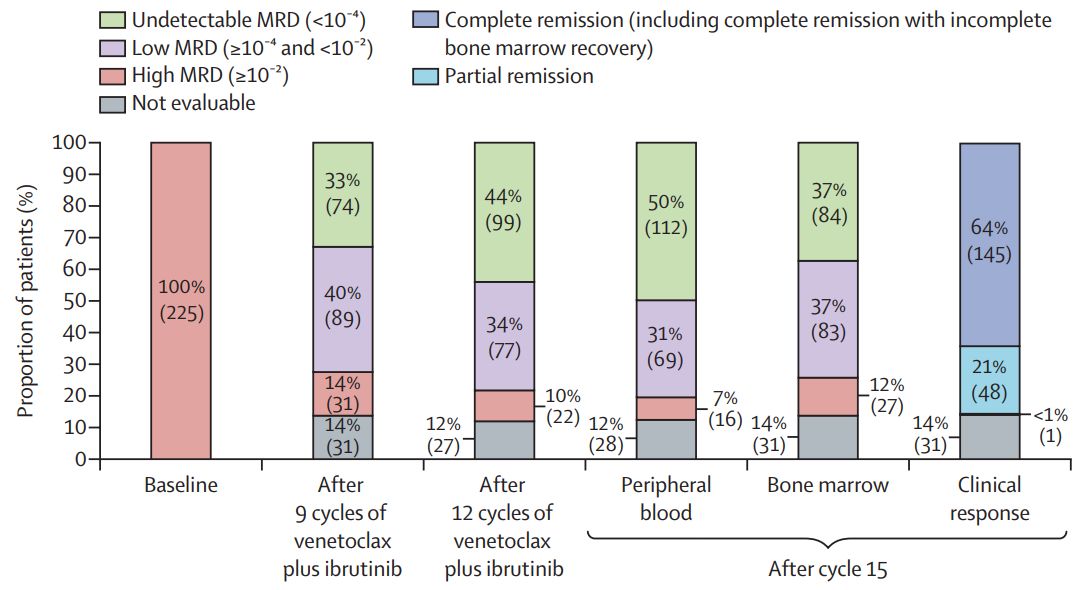
图2
225例患者中,有188例患者(84%)完成了维奈克拉联合伊布替尼治疗,直到第15个周期进行随机分组。188例患者中有107例患者获得外周血MRD阴性,其中78例患者(73%)获得骨髓MRD阴性。225例患者中有72例外周血和骨髓MRD阴性患者接受了随机分组(24例患者继续予以伊布替尼治疗,48例患者停止用药)。
截至2021年6月22日,中位随访34.4个月(IQR 30.6-37.9),208例患者存活且未失访。225例患者的预估27个月PFS率为88%(95%CI 83-92),预估27个月OS率为94%(95%CI 90-97)。研究达到主要终点,随机分组后停止治疗组27个月PFS率为98%(95%CI 89–100),高于预先设定的75%;继续予以伊布替尼治疗组患者预估27个月PFS率为96%(95%CI 79-100)。
安全性分析
在随机分组前的15个周期中,225例患者中有206例患者(92%)报告了≥1次不良事件(AE)。225例患者中有107例(48%)发生严重AE。感染(130/225,58%)、中性粒细胞减少(91/225,40%)和胃肠道不良事件(53/225,24%)是前15个周期中报告最常见的AE。在维奈克拉剂量爬坡期间,225例患者中有11例患者(5%)报告了2-3级肿瘤溶解综合征(TLS),均为实验室TLS。
15个周期后,未进行随机分组且继续进行伊布替尼维持治疗的116例患者中,有46例患者(40%)在治疗中发生严重AE。随机分组后,24例继续伊布替尼治疗患者中,有8例患者(33%)发生严重AE,1例患者(4%)发生房颤;48例停止治疗患者中,有4例患者(8%)发生严重AE,未报告有房颤(表2)。
表2
研究结论
在MRD的指导下,伊布替尼+维奈克拉限时治疗对R/R CLL具有有利的获益-风险特征。但考虑试验的局限性,研究结果应被认为是描述性结果,关于长期生存的决定性数据尚待公布。停止治疗后无患者发生疾病进展,随访中MRD复阳和再次出现CLL症状的患者成功地重新开始治疗,这提示在MRD指导下停止治疗或基于MRD对R/R CLL患者重新开始靶向治疗是可行的。
参考来源:
Kater AP, et al. Minimal residual disease-guided stop and start of venetoclax plus ibrutinib for patients with relapsed or refractory chronic lymphocytic leukaemia (HOVON141/VISION): primary analysis of an open-label, randomised, phase 2 trial. Lancet Oncol. 2022 Jun;23(6):818-828.
相关信息

服务号

订阅号
无极血康中医医院 冀ICP备05003291号-1 网站建设:中企动力 石家庄 SEO



