马军教授:砥砺前行,为患者争取长久生存,共商良策,为患者谋取最大福祉
陈苏宁教授解读阿伐曲泊帕治疗急性白血病化疗相关性血小板减少症的疗效及安全性
张磊教授:ITP二线治疗“欣”进展,助推临床疗效“欣”提升
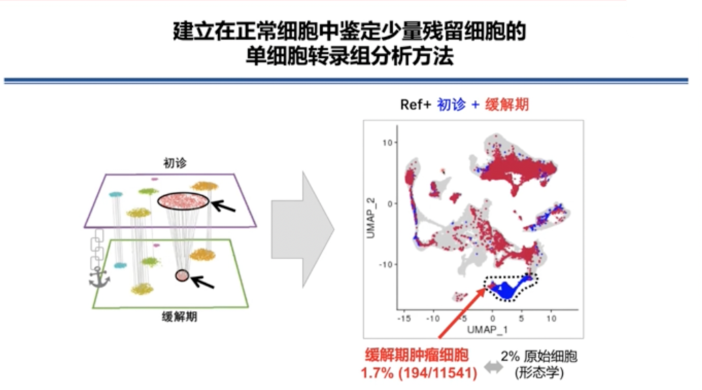
单细胞转录组分析揭示了AML患儿白血病干/祖细胞的异质性和化疗耐药特征
未来3年,全国医院的发展方向定了
上一页
1
2
...
6
下一页

服务号

订阅号
无极血康中医医院 冀ICP备05003291号-1 网站建设:中企动力 石家庄 SEO